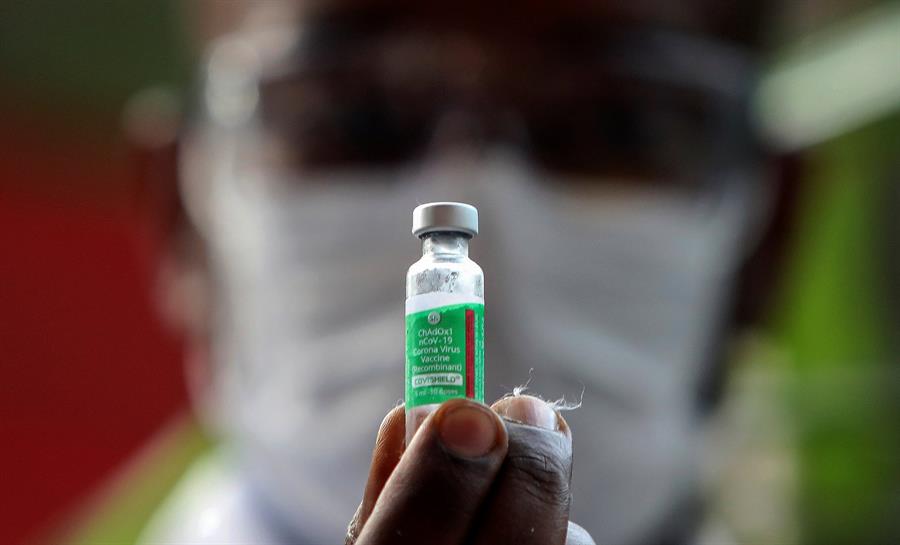
Após uma nova determinação da Agência Nacional de Vigilância Sanitária (Anvisa), a realização dos estudos clínicos da fase 3 do desenvolvimento de vacinas contra a Covid-19 deixou de ser obrigatório. O novo protocolo foi anunciado pela agência nesta quarta-feira, 3, e visa simplificar o processo de aprovação do uso emergencial de vacinas no Brasil. Além da mudança em relação aos testes, a Anvisa agora terá um prazo de até 30 dias para analisar os pedidos feitos de acordo com as novas regras. As mudanças devem permitir que outras vacinas passem a ser utilizadas no Brasil. Atualmente, apenas a Coronavac, desenvolvida pelo Instituto Butantan e pela Sinovac, e a vacina da Universidade de Oxford em parceria com a AstraZeneca estão sendo utilizadas.
Fonte: Jovem Pan