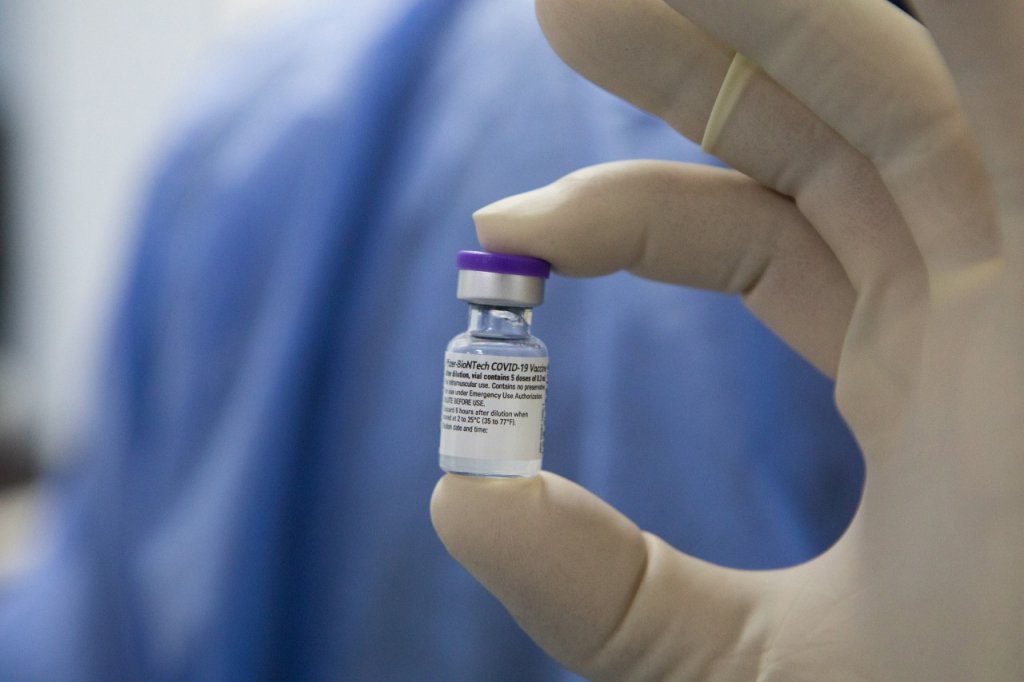
Autoridades e especialistas comemoraram a aprovação do uso da vacina da Pfizer em adolescentes acima de 12 anos no Brasil. A ampliação foi autorizada pela Agência Nacional de Vigilância Sanitária nesta sexta-feira, 11. A vacina da Pfizer já estava autorizada para uso em adolescentes com mais de 16 anos no país, além de já ser usada na faixa etária de 12 a 15 anos nos Estados Unidos e na Europa. Os estudos para aplicação do imunizante em crianças de seis meses a 11 anos está em curso. O coordenador do Comitê de Infectologia Pediátrica da Sociedade Brasileira de Infectologia, Marcelo Otsuka, ressaltou que quanto mais pessoas imunizadas, menor a circulação e o impacto do vírus.
“A gente sabe que a chance de uma criança ter uma infecção mais grave, mais severa, pelo coronavírus, ela é muito menor. Mas isso não significa que não possa acontecer. E mesmo com as variantes novas, o que a gente percebe é que a quantidade de crianças que ficam doentes, proporcionalmente, continua igual.” Em São Paulo, o cronograma de vacinação ainda não incluiu jovens abaixo dos 18 anos. O secretário de Saúde do Estado de São Paulo, Jean Gorinchteyn, ressaltou que é preciso direcionamento do governo federal. “Para que nós possamos inserir esses novos grupos etários, nós precisamos da deliberação do Ministério da Saúde através do Plano Nacional de Imunização. Além do que precisamos receber mais imunizantes, no caso da própria Pfizer, para poder dar segmento para essa faixa etária.”
O secretário municipal da Saúde, Edson Aparecido, foi na mesma linha e disse que é preciso uma sinalização de instâncias superiores. “A cidade está completamente preparada para receber as vacinas da Pfizer. Nós podemos armazenar quatro milhões de doses da Pfizer aqui na cidade. Temos todas as condições de receber os insumos da Pfizer.” Um novo lote de vacinas da Janssen deve chegar no Brasil nos próximos dias e os governos preparam uma força-tarefa para distribuir rapidamente devido ao prazo de validade de três meses. Na tarde desta sexta, a Anvisa se reuniu com representantes da empresa para discutir a extensão deste período. A proposta da empresa é ampliar para quatro meses e meio, medida aprovada pela agência reguladora dos Estados Unidos. A Diretoria Colegiada da Anvisa deve finalizar a análise das informações apresentadas pela Janssen na próxima semana.
Fonte: Jovem Pan