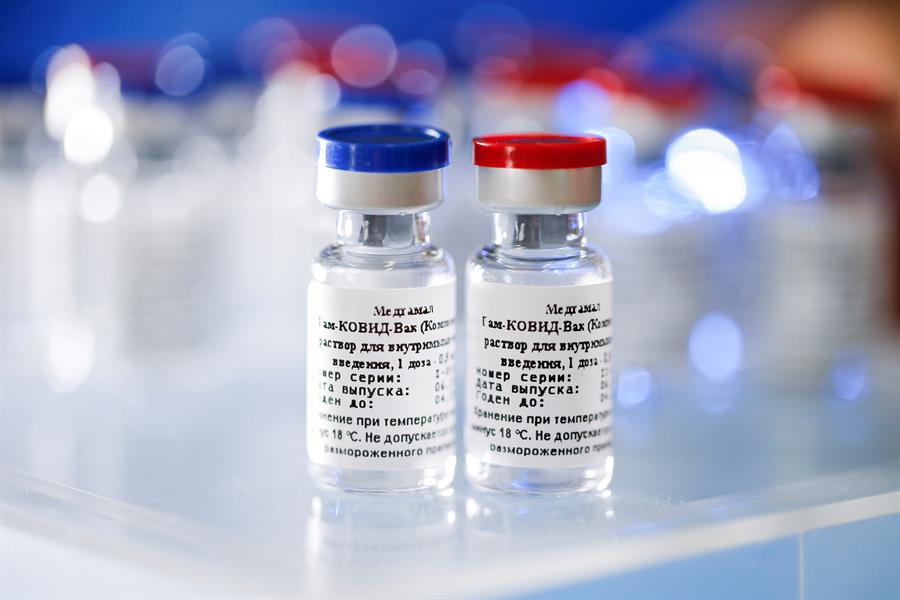
A Agência Nacional de Vigilância Sanitária (Anvisa) decidiu nesta sexta-feira, 4, autorizar a importação e distribuição da vacina indiana Covaxin e da vacina russa Sputnik V no Brasil. Em caráter excepcional e temporário, os imunizantes foram aprovados pela maioria da diretoria já que três diretores votaram pela autorização e apenas um integrante se opôs. As análises dos diretores foram feitas após pedidos separados do Ministério da Saúde (pela Covaxin) e de uma série de governos estaduais do Nordeste (pela Sputnik V). A aprovação da vacina é baseada na resolução RDC nº 476, de 10 de março de 2021, que permite a importação excepcional de imunizantes após análise de relatórios técnicos que basearam as aprovações das vacinas no exterior.
“Em uma pandemia em que milhares de pessoas morrem diariamente, essa decisão de avaliar plataformas vacinais é sempre muito complexa”, afirmou o diretor da Anvisa, Alex Machado Campos, ao votar a favor dos dois imunizantes após um discurso de mais de 1 hora. Campos citou que a aprovação das vacinas não podem se feita “a qualquer custo e à sombra do desespero”, mas mencionou uma possível terceira onda da pandemia no Brasil entre junho e julho desse ano. Os diretores Rômison Rodrigues Mota, Meiruze Souza e Antonio Barra Torres acompanharam o voto do relator, Alex Machado Campos, pela aprovação dos imunizantes. A diretora Cristiane Jourdan rejeitou a aprovação de ambos imunizantes.
Condicionantes
Tanto para a Covaxin quanto para a Sputnik V, a agência determinou uma série de condicionantes para a aplicação no público. No caso da vacina russa, todos os lotes entregues ao Brasil precisam ser provenientes de plantas produtivas inspecionadas anteriormente pela Anvisa e têm que passar por análise laboratorial que assegure a qualidade dos imunizantes. Além disso, as vacinas não podem ser utilizadas em pessoas com hipersensibilidade aos componentes da fórmula, grávidas, lactantes menores de idade, mulheres que desejam engravidar nos próximos 12 meses ou pessoas com enfermidades graves, como insuficiência hepática ou renal, patologias endócrinas ou problemas cardiovasculares. A Anvisa também exigiu a suspensão da importação das vacinas caso ela mesma ou a Organização Mundial da Saúde (OMS) reprove o uso emergencial do imunizante e determinou que as pessoas que forem vacinadas precisarão ser avisadas que a vacina importada não tem avaliação da Anvisa quanto aos critérios de qualidade, eficácia e segurança.
No caso do imunizante indiano, o laboratório responsável pelo desenvolvimento das vacinas deverá apresentar resultados de imunogenicidade e o relatório clínico de segurança em datas pré-determinadas, além de exportar vacinas feitas em plantas produtivas já inspecionadas pela agência, que passarão por exame laboratorial que demonstrem a potência e o conteúdo antigênico do imunizante, assim como seu padrão de qualidade. As contraindicações para menores de idade, alérgicos à fórmula, mulheres grávidas, lactantes ou que querem engravidar nos próximos 12 meses também são mantidas, assim como as contra-indicações para outras pessoas, como portadores de HIV e hepatite. Todas essas informações devem ser fornecidas em bulas escritas em português e distribuídas às unidades de saúde. A importação e distribuição da vacina deverá ser suspensa caso o uso emergencial dela seja reprovado no futuro e, assim como para a Sputnik V, os usuários precisarão ser avisados que a vacina não tem avaliação de qualidade, eficácia e segurança da Anvisa.
Fonte: Jovem Pan